1. サプレッサー変異法による熱安定性および活性の向上
酵素は高い特異性を有しており、温和な条件で効率的に反応を行うことが可能である。このような酵素の特質は、化成品の生産プロセスのグリーン化にも有効であり、酵素の産業利用はますます広がっていくものと予想される。しかしながら、酵素を産業利用する上で、その熱安定性や活性が十分でない場合もある。したがって、酵素の熱安定性、活性向上技術は重要と考えられるが、理論的設計による方法は確立していない。
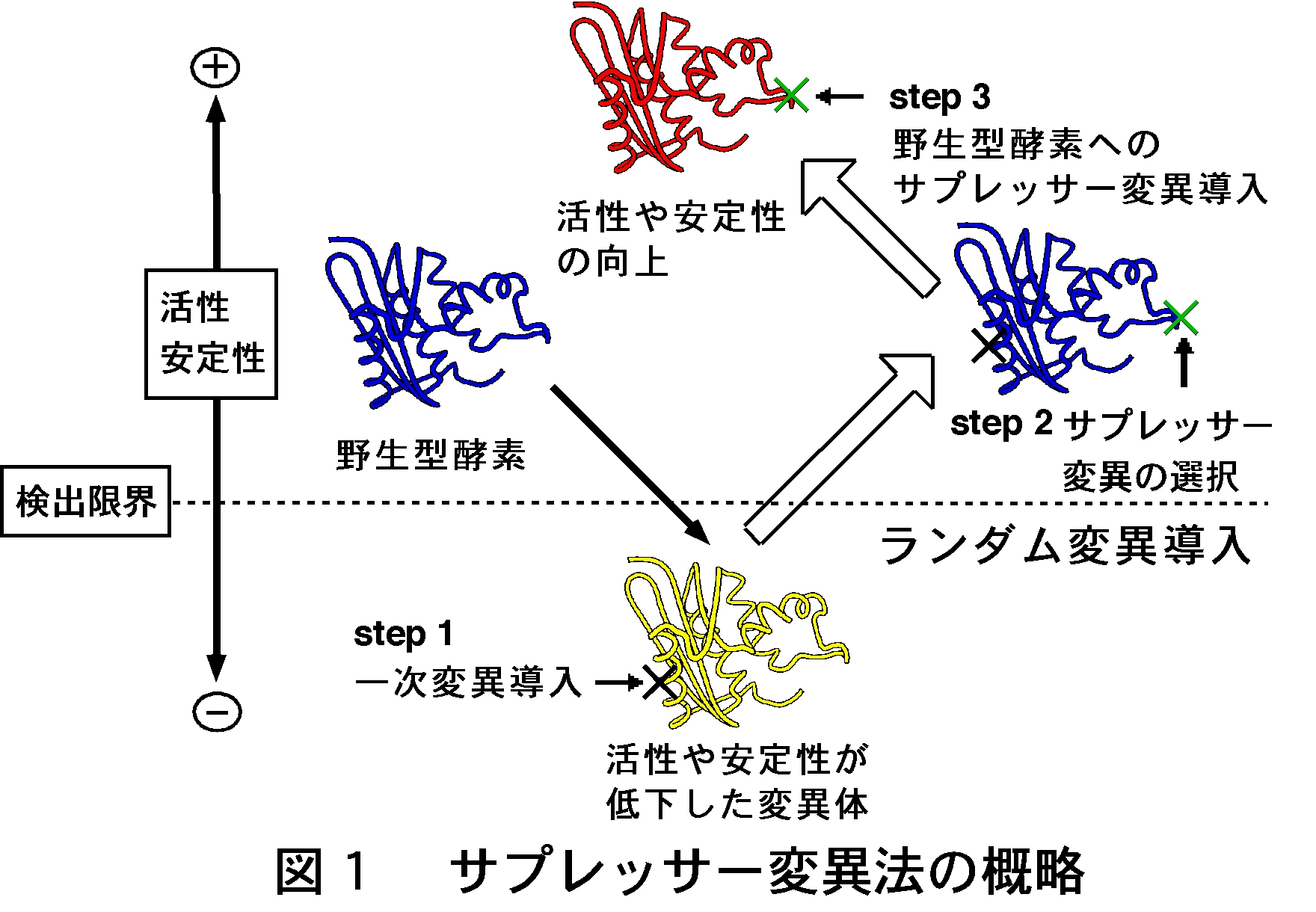
他方、ランダム変異を導入し、熱安定性や活性の向上した変異体をセレクションする方法は有効であり、近年多く用いられている。変異体を効率よくセレクションするには、バックグラウンドを低く抑える必要がある。そのひとつの方法として、サプレッサー変異法が用いられる。
サプレッサー変異法では、まず野生型酵素に変異を導入し、セレクションの検出限界以下になるように熱安定性や活性を低下させておく(図1, step 1)。つぎに、この変異体にランダム変異を導入し、分子内サプレッサー変異により熱安定性や活性が回復し、セレクションの検出限界を越えたものを選択する(図1, step 2)。サプレッサー変異(抑制変異)とは、ある変異により生じる効果をうち消すような変異のことである。このようなサプレッサー変異を野生型酵素に導入することにより、熱安定性や活性を向上させることができると期待される(図1, step 3)。
このような方法により、筆者らは、RNA/DNAヘテロ二重鎖のRNA部分を特異的に切断する酵素である、リボヌクレアーゼHI (RNase HI) の熱安定性、活性の向上を試みた。セレクションには、温度感受性を示す大腸菌RNase HI欠損株(MIC3001株)を利用した。MIC3001株に野生型RNase HI遺伝子を導入すると、その温度感受性は相補される。一方、大腸菌RNase HIのC末端を13残基欠損させると、熱安定性が著しく低下するため、MIC3001株に導入しても、温度感受性は相補されない。この欠失変異体遺伝子にランダム変異を導入し、MIC3001株の温度感受性を相補するようなサプレッサー変異をセレクションした。その結果、13種類の独立な変異が見いだされ、そのうち10種類の変異は、野生型のRNase HI のpH 5.5 における熱安定性を、Tm(融解温度)で比較して0.8 ℃〜7.8 ℃上昇させた。このうちAla52→Val など8種類の変異は新規に見いだされたもので、本セレクション法は熱安定化変異を高頻度で取得するのに有効な方法であることが示された1)。
高度好熱菌RNase HIは、熱安定性は高いが常温での活性は低い。そこで、熱安定性を保持したまま、常温における活性を向上させることを目指した。Asp134→His変異体は、活性の低下のため、MIC3001株の温度感受性を相補しない。この変異体遺伝子にランダム変異を導入し、MIC3001株の温度感受性を相補するようなサプレッサー変異をセレクションした。その結果、30 ℃においてkcat/Km値を野生型酵素の2.1〜4.8倍に上昇させる3種類の変異が得られ、これらの変異を組み合わせることによりkcat/Km値を約40倍に上昇させることに成功した(図2)2)。
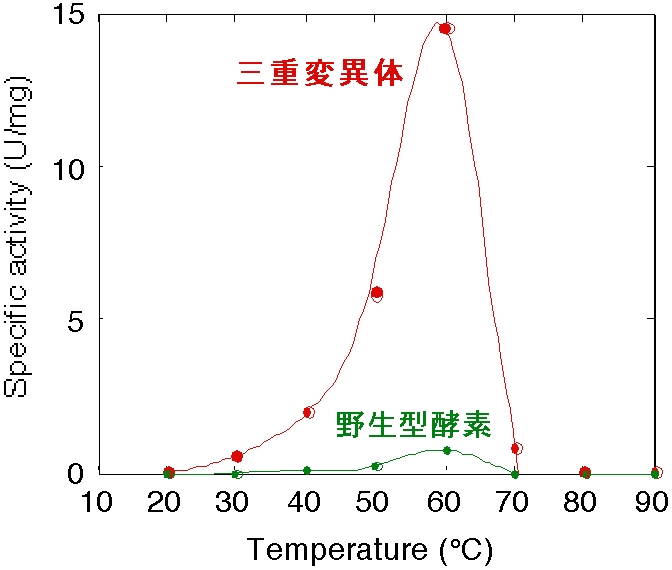
図2 サプレッサー変異法による高度好熱菌RNase HIの活性向上
2. タンパク質変異体安定性プロフィールの予測に基づく部位特異的およびランダム変異導入による大腸菌リボヌクレアーゼHIの熱安定化の向上
大腸菌RNase HIにおいて,タンパク質変異体安定性プロフィール(SPMP)により,Lys99, Asn100, Val101への変異導入は,大きく安定性を向上させると予測された。そこで,Lys99, Asn100については,SPMPにより,最も安定性を向上させると予測される置換(K99P, N100G)を導入した。その結果,K99P変異体は野生型より,pH 5.5におけるTmが約1.8℃上昇した。Val101については,ランダム変異を導入し,安定化変異のセレクションを行った。セレクションの結果,Ala, Arg, Glnに置換した変異体が得られ,V101A変異体は野生型より,pH 5.5におけるTmが約2℃上昇した3)。
3. ランダム変異導入による大腸菌エステラーゼの活性向上
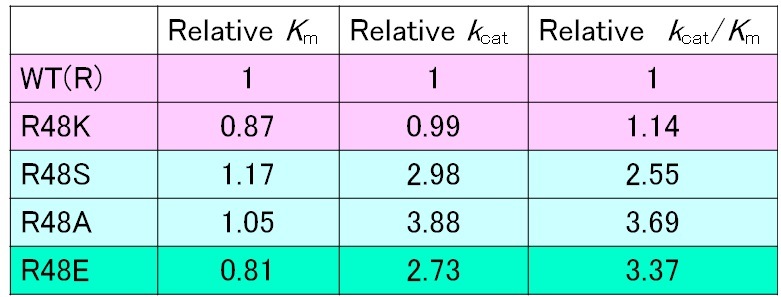
大腸菌エステラーゼ遺伝子にランダム変異法を導入し,トリブチリン寒天培地を用いて活性向上変異体のスクリーニング行ったところ,Arg48→Ser(R48S)変異体が見いだされた。R48S変異体は,Kmにほとんど変化は見られず,kcatが約3倍に増大していた(表1)。また,Arg48を電荷を持たないAlaおよび負電荷を持つGluに置換すると,同様なkcatの増大が見られた(表1)。これに対し,正電荷を持つLysに置換した場合は,kcatの増大は見られなかった(表1)。ホモロジーモデリングを用いた大腸菌の立体構造予測により,Arg48は基質結合ポケットの入り口部分に位置することが示唆された。従って,基質の分解後に生じる生成物の脂肪酸の負電荷とArgの正電荷との相互作用が,Serへの置換により解消されることにより,生成物が解離しやすくなり,触媒効率が向上したと考えられる4)。
表1 エステラーゼ活性向上変異体の反応速度論的解析