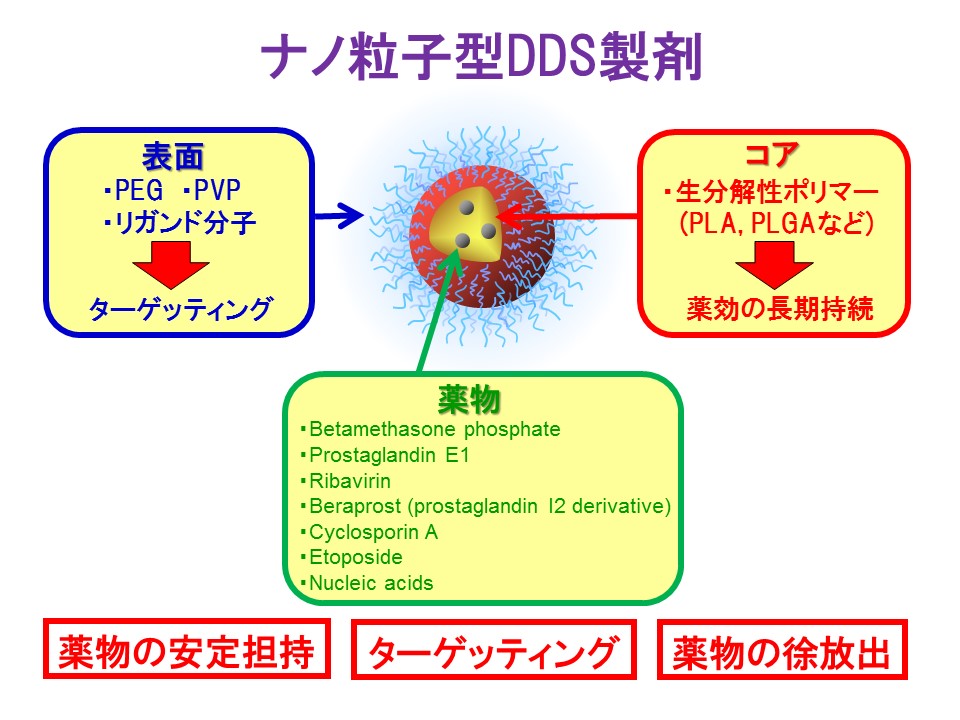
DDSによる治療を実現するには、多くの場合薬のキャリア(乗り物/運搬体/担体)が必要とされます。当研究室ではキャリアとして、ウイルスほどの大きさで合成高分子からなるナノ粒子を人工的に作製しています。ナノ粒子のコア基材となる合成高分子としては、ポリ乳酸(PLA)やポリ(乳酸-グリコール酸)(PLGA)を用いています。これらは、バイオプラスチックの工業用資材としてだけでなく、その体内分解性(低蓄積性)・生体適合性・低免疫原性から医療用材料としても長年利用されてきました。また、医薬品としてもリュープリン(武田薬品工業)の開発成功以来これらの高分子を用いた多くの粒子型製剤が上市されています。一方、ナノ粒子表面を修飾する合成高分子としては、ポリエチレングリコール(PEG)やポリビニルピロリドン、ポリペプチドなどを用いています。中でもPEGは多くの医薬品で既に利用されており、PEGを化学修飾したタンパク質や表面修飾した粒子製剤が上市されています。
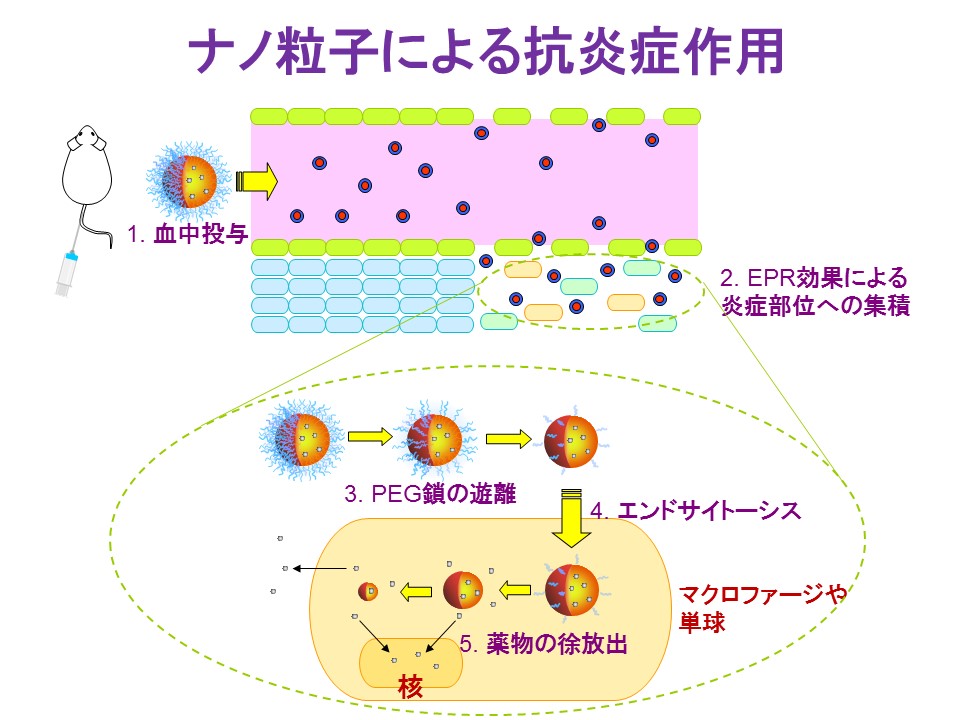
当研究室では、これら合成高分子のブレンドを利用し、時間的(持続時間)及び空間的(体内動態)に薬理効果を制御できる高分子ナノ粒子型DDS製剤の開発を試みています。しかし、このような固体のナノ粒子では、薬物を安定に保持できる利点がある反面、薬物のナノ粒子内への封入効率が低く、特に水溶性薬物を封入することが困難なため、薬物の種類が著しく制限されてきました。当研究室では、これまでに亜鉛や鉄などの金属イオンを用いることで様々な水溶性薬物を効率よく封入できる技術を確立してきました。薬物としては、ステロイドのリン酸ベタメサゾン、プロスタグランジンE1(PGE1)、PGI2誘導体のベラプロスト、抗ウイルス剤のリバビリン、免疫抑制剤のシクロスポリンなどを封入させることに成功しています。これらの粒子製剤では、血中でも物理的に安定に薬物を粒子内に保持できるのに加え、病変部位で薬物を粒子から徐放出できること、そして炎症組織や肝細胞、血管閉塞部位など疾患に応じた病変部位へ薬物を集積できることが既に明らかになっています。